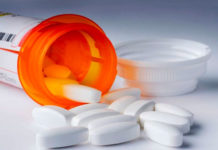

Una píldora que ha sido utilizada para tratar el VIH ha dado un paso más para convertirse en el primer fármaco aprobado para evitar que las personas sanas se infecten con el virus que causa el SIDA.


El jueves un grupo de asesores de la FDA considerará la revisión cuando se vote sobre si Truvada debe ser aprobado como un tratamiento preventivo para las personas que están en alto riesgo de contraer el VIH por vía sexual. La FDA no está obligada a seguir el consejo de sus paneles, pero normalmente lo hace.
Se estima que 1,2 millones de estadounidenses tienen VIH, que ataca el sistema inmunológico y, si no se trata con medicamentos antivirales, se convierte en SIDA, una enfermedad mortal en la cual el cuerpo no puede combatir las infecciones. Si Truvada se aprueba, sería un gran avance en la campaña de 30 años contra la epidemia del SIDA. No se han probado otras drogas para prevenir el VIH y la vacuna se cree que está a décadas de distancia.
Gilead Sciences Inc., con sede en Foster City, California, ha comercializado Truvada desde 2004 como tratamiento para personas que están infectadas con el virus. El medicamento es una combinación de dos medicamentos contra el VIH, Emtriva y Viread. Los médicos suelen prescribir los medicamentos como parte de un cóctel de drogas que hace más difícil que el virus se reproduzca. Los pacientes con bajos niveles de carga viral han reducido los síntomas y son mucho menos propensos a desarrollar el SIDA.
Los investigadores informó por primera vez que Truvada podría prevenir las personas de contraer el VIH en 2010. Un estudio de tres años encontró que las dosis diarias reducen el riesgo de infección en hombres sanos con comportamiento homosexuales o bisexuales en un 44 por ciento, cuando se acompaña de preservativos y asesoramiento. Otro estudio encontró que Truvada redujo la infección en un 75 por ciento en parejas heterosexuales en las que se infectan uno de los parceros con el VIH y el otro no lo era.
Debido a que Truvada ya está en el mercado para controlar el VIH, algunos médicos ya la prescriben como una medida preventiva. Sin embargo, la aprobación de la FDA permitirá a la compañía farmacéutica Gilead comercializar formalmente su medicamento para ese uso.
Revisores de la FDA el martes, dijeran que los pacientes deben ser diligentes en tomar la píldora todos los días si se lo emplea como una medida preventiva. La adherencia a la medicación era menos que perfecta en los ensayos clínicos, y los revisores, dijeran que los pacientes en el mundo real pueden olvidarse de tomar sus medicamentos, incluso más que aquellos en los estudios clínicos.