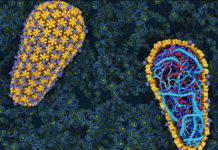
Los científicos finalmente han recreado los pasos iniciales de la infección por VIH en un tubo de ensayo, ofreciendo una vista increíblemente ampliada del virus en acción.
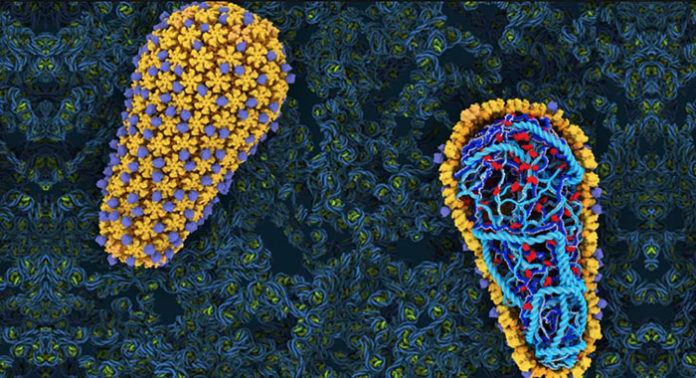
Las sorprendentes imágenes muestran una capa cónica de mosaicos geométricos, llamada cápside, que se encuentra en el centro del virus y contiene su material genético, conocido como ARN.
Antes de infiltrarse en una célula, la cápside está rodeada por una envoltura de moléculas grasas; esta envoltura se fusiona con la célula huésped para dejar entrar la cápside, donde luego lleva el ARN al núcleo de la célula. En el camino, el ARN se replica y, una vez dentro del núcleo, invade el ADN del huésped.
Al otorgar una mirada más cercana a este proceso de replicación, el nuevo estudio destaca que la cápside en sí juega un papel crítico en la infección y que se deben cumplir criterios específicos para que el virus entreteje su genoma con el de la célula huésped.
Saber cómo recrear los pasos iniciales de la infección por VIH «significa que tenemos muchas más herramientas para analizar el proceso de replicación», dijo el autor del estudio Wesley Sundquist, profesor distinguido de bioquímica en la Universidad de Utah Health.
En particular, el estudio, publicado el 8 de octubre en la revista Science, describe un sistema libre de células que se puede utilizar para estudiar cómo el VIH invade el genoma del huésped; tal sistema podría «revolucionar los experimentos del VIH en muchos laboratorios», Leo James, un líder de grupo en el Laboratorio de Biología Molecular MRC, que no participó en el estudio, dijo a WordsSideKick.com en un correo electrónico.
«Haber logrado todo esto es un verdadero tour de force», dijo James. Más allá de la investigación básica, el sistema también podría ayudar a explicar cómo los medicamentos experimentales que se dirigen a la cápside funcionan para limitar la replicación del VIH, dijo Sundquist en un comunicado.
Ensayos de probeta
Aunque los experimentos de probeta capturan aspectos de la infección por VIH con gran detalle, no pueden recrear cada paso del proceso, anotó Sundquist. La infección generalmente comienza cuando la membrana externa del virus se fusiona con la membrana de una célula huésped, lo que permite que la cápside y sus entrañas se cuelen dentro. Pero con un sistema sin células, los autores tuvieron que pasar por alto este paso inicial.
En su lugar, utilizaron un compuesto que se encuentra en el veneno de abeja, llamado melitina, para «permeabilizar» la membrana viral y liberar la cápside contenida en su interior.
La cápside del VIH tiene poros diminutos y, normalmente, cuando una partícula de virus flota a través del citoplasma de una célula humana, recoge los componentes celulares del ADN, llamados desoxinucleótidos trifosfatos, que ya están allí, según un informe de 2017 en la revista Nature.
A medida que viaja al núcleo, la partícula del virus utiliza esos componentes básicos para hacer copias de hebras completas de ADN, gracias a una enzima especial alojada dentro de la cápside. Así es como el virus copia su material genético para luego insertarlo en el genoma del hospedador. La forma en que el virus «sabe» cuándo comenzar esta llamada transcripción inversa es todavía algo misteriosa, pero los estudios sugieren que las propiedades bioquímicas de la célula huésped actúan como señales para que comience la reacción.
Pero un tubo de ensayo no tiene automáticamente componentes básicos de ADN en solución, por lo que los autores los agregaron para impulsar la transcripción inversa. «Este método ha existido por un tiempo, pero es complicado lograr que la reacción se desarrolle hasta su finalización», señaló James. Pero los autores del estudio lograron que la transcripción inversa funcionara sin problemas; para hacerlo, aprendieron que la cápside debe permanecer casi intacta durante todo el proceso.
«La cápside tiene que estar en gran parte intacta, y tiene que tener la estabilidad o flexibilidad adecuadas, para soportar la transcripción inversa», lo que significa que la cápside debe estar lo suficientemente unida para no deshacerse durante la transcripción inversa, pero capaz de abrirse cuando el la cápside entra en el núcleo para liberar su ADN copiado, dijo Sundquist. Afortunadamente, los científicos descubrieron recientemente una forma de mantener la cápside lo suficientemente estable.
El autor del estudio, Owen Pornillos, profesor asociado de fisiología molecular y física biológica en la Universidad de Virginia, y sus colegas encontraron que un compuesto llamado IP6 se une a la superficie de mosaico de la cápside, informaron en 2018 en la revista Nature. IP6 lleva una carga negativa, mientras que cada placa lleva una carga positiva en el lado que apunta hacia el centro de la cápside; Dado que los opuestos se atraen, cuando el IP6 se une a la cápside, ayuda a colocar las baldosas en una disposición más firme y estable.
«Antes del descubrimiento de IP6, alguien quitaba la envoltura [viral] in vitro y todo se derrumbaba y no podían ver nada», dijo João Mamede, profesor asistente del Departamento de Patógenos Microbianos e Inmunidad de la Universidad Rush, quien no participó en el estudio.
El IP6 es «bastante abundante» en las células, por lo que en sus experimentos de probeta, los autores agregaron concentraciones similares del compuesto a las que se encontrarían en las células, dijo Sundquist. «Ese fue realmente el truco», agregó. «Hasta que lo supimos, estábamos trabajando con cápsides que eran demasiado inestables».
Ver para creer
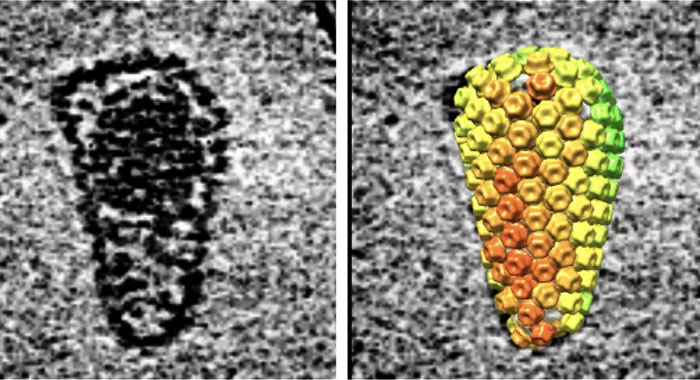
Usando modelos informáticos de moléculas y un microscopio electrónico, los autores pudieron ver literalmente que las 240 baldosas que componen la cápside mantenían estable su estructura enrejada durante la transcripción inversa.
A medida que las hebras de ADN se hicieron más grandes, sus extremos a veces asomaban a través de pequeños huecos en el tejido de celosía, señalaron los autores, y a veces se podían ver baldosas singulares desprendiéndose mientras el resto de la cápside permanecía intacto.
Es posible que la cápside deba permanecer estable para mantener cerca el ARN y la enzima de transcripción, dijo Christopher Aiken, profesor de patología, microbiología e inmunología en la Universidad de Vanderbilt, que no participó en el estudio.
La enzima tiende a desprenderse del ARN durante la transcripción, por lo que «al mantener la enzima contenida, puede volver a unir la plantilla y continuar la síntesis de ADN», dijo Aiken a WordsSideKick.com en un correo electrónico.
Con la transcripción inversa completa, los autores pasaron al siguiente paso en la infección: la integración, donde el ADN viral se infiltra en el genoma del huésped. Introdujeron hebras de ADN conocidas como plásmidos en sus tubos de ensayo, para que sirvieran como representantes del ADN en un núcleo humano, pero la integración no comenzaría sin un ingrediente adicional. Sólo los «extractos de células completas», una mezcla de proteínas y moléculas extraídas de las células, permitirían que el ADN viral impregnara los plásmidos.
En el futuro, el equipo espera identificar con precisión qué ingredientes en los extractos celulares desencadenan la integración, dijo Sundquist. «Es probable que sea más de una cosa», anotó. Un desafío es que, en los experimentos de probeta, «siempre es difícil saber si te falta algo», dijo.
Una limitación del estudio es que no puede recrear perfectamente las condiciones celulares, dijo James.
«Cualquier sistema in vitro, por poderoso que sea, solo se puede usar para probar los componentes que conocemos y que podemos agregar a la reacción», dijo James. Por ejemplo, en las células reales, la cápside debe viajar al núcleo celular, donde se mantiene el ADN, y luego deslizarse a través de portales conocidos como poros nucleares. Puede haber factores desconocidos que alteren la cápside durante este viaje, anotó Sundquist.
Dicho esto, el nuevo sistema sin células podría ayudar a revelar la identidad de esos factores desconocidos, agregó Mamede. Los científicos ahora pueden hacer observaciones en un entorno libre de células y luego verificar si el mismo comportamiento aparece en las células reales, dijo.
Además, el sistema podría resultar útil en el desarrollo de fármacos. «Puede probar [nuevos fármacos] más fácilmente con uno de estos sistemas simplificados que con una célula», dijo Mamede a WordsSideKick.com. «De esta manera, puede ver mecánicamente lo que realmente le está haciendo al virus».
La compañía farmacéutica Gilead Sciences tiene actualmente un nuevo fármaco en ensayos en humanos que se dirige específicamente a la cápside del VIH, según ClinicalTrials.gov. Según los primeros datos, el fármaco parece alterar la cápside en varios puntos de infección, incluso durante la transcripción inversa. Sundquist dijo que el estudio sin células subraya que la cápside es un «componente crítico» de la infección por VIH y que la corrupción de la cápside puede limitar la capacidad del virus para multiplicarse.