
Las células cancerosas metastatizan en varias etapas primero por la invasión de los tejidos circundantes, a continuación, mediante la infiltración y la difusión a través del sistema circulatorio. Algunas células circulantes trabaja su manera de salir de la red vascular, formando un tumor secundario.
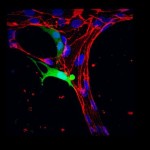

Ahora, los investigadores del MIT han desarrollado un dispositivo de microfluidos que imita el flujo de las células cancerosas a través de un sistema de vasos sanguíneos. Uso de alta resolución time-lapse de imágenes, los investigadores capturaron los momentos como una célula cancerosa aprieta su camino a través de una pared de un vaso sanguíneo en la matriz extracelular circundante. El proceso es «muy dinámica», ya que escribir en un artículo publicado en la revista Biología Integrativa, una mejor comprensión de la misma puede ayudar a los científicos a identificar terapias para prevenir la metástasis.
«Ahora que tenemos un modelo de extravasación, se puede pensar acerca de su uso como pantalla de medicamentos que podrían prevenir», dice Roger Kamm, el Cecil e Ida Verde distinguido profesor de Biología e Ingeniería Mecánica en el MIT. «Podríamos tomar células tumorales circulantes de un paciente y los someterán las células a un puñado de factores o fármacos. Eso es en definitiva lo que nos gustaría hacer, pero en el proceso que estamos aprendiendo mucho sobre la marcha.»
Kamm Los co-autores en el papel son estudiantes de posgrado Michelle Chen, Jordania Whisler y Jessie Jeon.
Siembra de los vasos sanguíneos
Mientras que las células tumorales se abren camino a través del sistema circulatorio, un poco de «arresto», o hacer una pausa en un lugar determinado, la adhesión a un vaso de sangre en la pared de la primera etapa de la extravasación. Los científicos han pensado que este arresto celular se produce en una de dos maneras: Una célula puede enviar proyecciones pegajosas que se llevan en el revestimiento de los vasos, o puede ser demasiado grande para pasar a través de, literalmente, quedar atrapados dentro del recipiente.
Para investigar que es más probable posibilidad , los investigadores cultivaron una red de pequeños vasos sanguíneos de una solución de células endoteliales del cordón umbilical humano . Se inyecta una solución que contiene las células vasculares en un pequeño dispositivo de microfluidos que contiene un depósito de hidrogel , junto con los factores normalmente presentes en el sistema circulatorio el desarrollo de crecimiento . Dentro de días , un intrincado sistema de microvasos tomó forma , con cada una de aproximadamente uno milímetro micras de largo y 10 a 100 de diámetro -dimensiones similares a capilares pequeña del cuerpo .
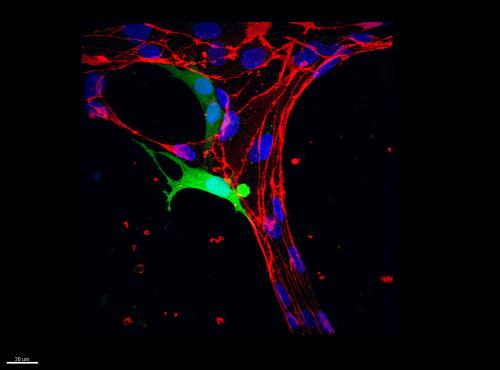
El grupo luego se bombea células tumorales a través de la red vascular , el uso de una línea de células de cáncer de mama conocidos por ser particularmente invasivo . Utilizando microscopía confocal de alta resolución , el equipo observó como las células tumorales fluyeron a través del sistema circulatorio en miniatura. Ellos observaron que la mayoría de las células que detenidos a lo largo de un recipiente lo hizo debido al atrapamiento es – que , simplemente se atascó .
Una célula tumoral encuentra una salida
Con las imágenes de lapso de tiempo , los investigadores tomaron una mirada más atenta a la evolución de los acontecimientos después de la detención celular. Una vez que una célula tumoral queda atrapado , observaron que envía de largo, filamentos delgados que empujan contra una pared del vaso , con el tiempo la creación de un pequeño agujero en el revestimiento endotelial . Más y más de la célula aprieta a través de los agujeros como dan paso , y con el tiempo , incluso el núcleo de la célula – cree que es una parte relativamente rígida , no deformable estructura – es capaz de escapar .
Para su sorpresa, los investigadores encontraron que el núcleo se realiza a través de la pared del vaso antes y más rápido de lo que esperaban , apretando a través de cerca de 15 minutos, » un pequeño pedazo del tiempo necesario para que toda esta celda para extravasarse «, señala Chen .
Curiosamente , Chen indica , una vez que una célula tumoral ha salido por completo de un vaso sanguíneo , el endotelio parece curarse a sí mismo , cerrando los huecos que creó inicialmente la célula . » Eso sugiere que la barrera endotelial tiene algún tipo de participación activa en la reparación de sí mismo después de esta invasión de las células tumorales «, dice Chen.
Además de observar la extravasación de las células tumorales individuales , el grupo también analizó el comportamiento de las células clústers de dos o más células cancerosas que se acumulan en un vaso sanguíneo. A partir de sus observaciones , los investigadores encontraron que casi el 70 por ciento de los grupos de células se rompió a través de una barrera de la sangre , en comparación con menos del 10 por ciento de las células individuales .
Pero algunas células que lo hacen fuera del sistema circulatorio aún pueden dejar de hacer metástasis . Para ver si la capacidad de una célula para extravasarse se correlaciona con su potencial metastásico , el grupo comparó la eficacia de la extravasación de diferentes líneas celulares de cáncer . Las líneas incluyen células de cáncer de mama , células de fibrosarcoma ( un cáncer del tejido conectivo ) , y una línea de células de cáncer no metastásicos .
Efectivamente, el equipo observó que la mayoría de las células metastásicas (células de fibrosarcoma ) también fueron los más propensos a extravasación , en comparación con el cáncer de mama y las células no metastásicos un hallazgo que sugiere que la selección de medicamentos para prevenir la extravasación puede frenar la metástasis del cáncer .
De cara al futuro , el grupo está estudiando la probabilidad de una célula cancerosa dado es a proliferar y agregados con otros una vez que ha salido en el tejido circundante . Los investigadores están modelando diversos tejidos dentro de la plataforma de microfluidos , incluyendo los huesos, para estudiar cómo las células cancerosas forman el comienzo de un tumor secundario .
«A pesar de esta plataforma no es una plataforma en -vivo y obviamente no puede captar todos los aspectos que se producen in vivo , hemos llegado mucho más cerca de la creación de una plataforma in-vitro que es incluso más fisiológicamente , de alta resolución pertinente y de alto rendimiento de una gran cantidad de plataformas anteriores » , dice Chen.
El documento se titula » Mecanismos de la extravasación de células tumorales en una plataforma en la red microvascular vitro «.
a través de el vaso, a través de vaso, al traves de vaso, vasos capilares con celulas cancerosas, creacion cancer de vasos sanguineos, el vaso sanguineo ayuda al tumor