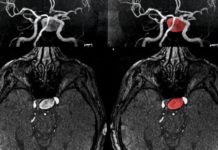

Los científicos de la Universidad de California en San Francisco han mejorado la movilidad en ratas que habían experimentado golpes debilitantes mediante el uso de la estimulación eléctrica para restaurar un patrón distintivo de la actividad de las células cerebrales asociado con el movimiento eficiente.
Los investigadores dicen que planean usar los nuevos hallazgos para ayudar a desarrollar implantes cerebrales que algún día podrían restaurar la función motora en pacientes con accidente cerebrovascular humanos.
Después de un accidente cerebrovascular, aproximadamente un tercio de los pacientes se recupera completamente, un tercio tiene problemas importantes de movimiento persistente y un tercio permanece virtualmente paralizado, dijo el autor principal Karunesh Ganguly, MD, Ph.D., profesor asociado de neurología y miembro del Instituto UCSF Weill para Neurociencias. Incluso los pacientes que experimentan una recuperación parcial a menudo continúan luchando con los movimientos «dirigidos a objetivos» de los brazos y las manos, como alcanzar y manipular objetos, que pueden ser cruciales en el lugar de trabajo y en la vida diaria.
«Nuestro ímpetu principal fue entender cómo podemos desarrollar la neurotecnología implantable para ayudar a los pacientes con accidente cerebrovascular», dijo Ganguly, que lleva a cabo investigaciones en el Sistema de Atención Médica de San Francisco VA. «Existe un enorme campo en torno a la idea de implantes neurales que pueden ayudar a los circuitos neuronales a recuperarse y mejorar la función. Estábamos interesados en tratar de comprender las propiedades del circuito de un cerebro lesionado en relación con un cerebro sano y utilizar esta información para adaptar los implantes neuronales para mejorar la función motora después del accidente cerebrovascular «.
En los últimos 20 años, los neurocientíficos han presentado pruebas de que los patrones coordinados de actividad neuronal conocidos como oscilaciones son importantes para la función cerebral eficiente. Más recientemente, se han encontrado específicamente oscilaciones de baja frecuencia (LFO), que se identificaron por primera vez en estudios del sueño, para ayudar a organizar el disparo de las neuronas en la corteza motora primaria del cerebro. La corteza motora controla el movimiento voluntario y los LFO bloquean la actividad de las células para garantizar que los movimientos dirigidos a objetivos sean suaves y eficientes.
En el nuevo estudio, publicado en la edición del 18 de junio de 2018 de Nature Medicine, los investigadores primero midieron la actividad neuronal en ratas mientras que los animales se acercaron para tomar una pequeña bolita de comida, una tarea diseñada para emular los movimientos humanos dirigidos a objetivos. Detectaron los LFO inmediatamente antes y durante la acción, lo que inspiró a los investigadores a investigar cómo podrían cambiar estos patrones de actividad después del accidente cerebrovascular y durante la recuperación.
Para explorar estas preguntas, causaron un accidente cerebrovascular en las ratas que perjudicaron la capacidad de movimiento de los animales, y encontraron que los LFO disminuyeron. En las ratas que pudieron recuperarse, realizando gradualmente movimientos más rápidos y precisos, los LFO también regresaron. Hubo una fuerte correlación entre la recuperación de la función y el resurgimiento de los LFO. Los animales que se recuperaron por completo tuvieron una actividad de baja frecuencia más fuerte que los que se recuperaron parcialmente, y los que no se recuperaron prácticamente no tuvieron actividad de baja frecuencia.
Para tratar de impulsar la recuperación, los investigadores usaron electrodos para registrar la actividad y administrar una corriente eléctrica suave al cerebro de las ratas, estimulando el área que rodea el centro del daño del golpe. Esta estimulación mejoró consistentemente los LFO en el área dañada y pareció mejorar la función motora: cuando los investigadores lanzaron una ráfaga de electricidad justo antes de que una rata hiciera un movimiento, la rata era hasta un 60 por ciento más precisa para alcanzar y agarrar una bolita de alimento.
«Curiosamente, observamos este aumento de los LFO solo en los ensayos donde se aplicó la estimulación», dijo Tanuj Gulati, Ph.D., un investigador postdoctoral en el laboratorio de Ganguly que es coautor del estudio, junto con Dhakshin Ramanathan, MD, Ph.D., ahora profesor asistente de psiquiatría en la Universidad de California en San Diego, y Ling Guo, estudiante de posgrado en neurociencia en UCSF.
«No estamos creando una nueva frecuencia, estamos amplificando la frecuencia existente», agregó Ganguly. «Al amplificar las oscilaciones débiles de baja frecuencia, podemos ayudar a organizar la actividad neuronal relacionada con la tarea. Cuando entregamos la corriente eléctrica al ritmo de las acciones previstas, el control del motor en realidad mejoró».
Los investigadores querían saber si sus hallazgos también podrían aplicarse a los seres humanos, por lo que analizaron las grabaciones realizadas en la superficie del cerebro de un paciente con epilepsia que había sufrido un accidente cerebrovascular que había perjudicado los movimientos del brazo y la mano del paciente. Las grabaciones revelaron significativamente menos LFO que las grabaciones realizadas en dos pacientes con epilepsia que no habían tenido un accidente cerebrovascular. Estos hallazgos sugieren que, al igual que en las ratas, el accidente cerebrovascular había causado una pérdida de actividad de baja frecuencia que alteraba el movimiento del paciente.
La fisioterapia es el único tratamiento actualmente disponible para ayudar a los pacientes con accidente cerebrovascular en su recuperación. Puede ayudar a las personas que pueden recuperarse neurológicamente a volver a ser completamente funcionales más rápidamente, pero no a aquellas cuyo daño cerebral es demasiado extenso. Ganguly espera que la estimulación eléctrica del cerebro pueda ofrecer una alternativa muy necesaria para estos últimos pacientes, ayudándoles a