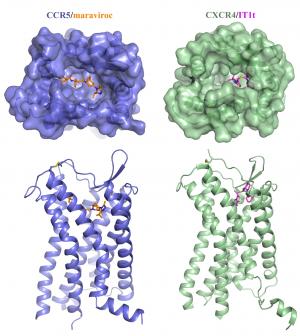
En un descubrimiento tan esperado, un equipo de científicos chinos y estadounidenses ha determinado la estructura atómica de alta resolución de un receptor de la superficie celular que la mayoría de las cepas del VIH utiliza para entrar en las células inmunes humanas. Los investigadores también demostraron que maraviroc, un medicamento contra el VIH, se une a las células y bloquea la entrada del VIH.
 «Estos detalles estructurales deberían ayudarnos a entender con mayor precisión cómo el VIH infecta a las células, y cómo podemos hacerlo mejor en el bloqueo de ese proceso con fármacos de última generación», dijo Beili Wu, PhD, profesor del Instituto de Materia Médica de Shanghai, la Academia China de Ciencias. Wu fue el investigador principal del estudio, que fue publicado en Science Express el 12 de septiembre de 2013.
«Estos detalles estructurales deberían ayudarnos a entender con mayor precisión cómo el VIH infecta a las células, y cómo podemos hacerlo mejor en el bloqueo de ese proceso con fármacos de última generación», dijo Beili Wu, PhD, profesor del Instituto de Materia Médica de Shanghai, la Academia China de Ciencias. Wu fue el investigador principal del estudio, que fue publicado en Science Express el 12 de septiembre de 2013.
El estudio, que se centró en el receptor CCR5 , fue apoyada tanto por los organismos de financiación de investigación de China y EE.UU. . » Las colaboraciones internacionales como éste son cada vez más necesarios para resolver los grandes problemas de la ciencia «, dijo el coautor del estudio, Raymond C. Stevens , PhD , un profesor en el Instituto de Investigación Scripps ( TSRI ) en California. » Ahora que tenemos tanto humanos CXCR4 y CCR5 del VIH co – receptor de estructuras tridimensionales , es probable que veamos la próxima generación de la terapéutica del VIH. »
Un objetivo importante
El receptor CCR5 es uno de los objetivos más codiciados para los nuevos medicamentos contra el VIH . Aunque el virus causante del SIDA se descubrió inicialmente para infectar células a través de otro receptor , CD4 , los investigadores encontraron en 1996 que la infección por el VIH también requiere un co-receptor CCR5 – por lo general , que se encuentra junto CD4 en una variedad de células inmunes.
Importancia de CCR5 a la infección por VIH es subrayada por el hecho de que ciertas variantes genéticas de que pueden aumentar drásticamente o menor riesgo de infección por el VIH , así como la velocidad del proceso de la enfermedad después de la infección . Una corta variante CCR5 , que se encuentra en alrededor del 10 por ciento de los europeos , no se expresa en absoluto en las superficies de células inmunes y las personas que producen sólo esta variante son casi invulnerables a la infección por el VIH.
Los científicos por lo tanto, han tratado de desarrollar medicamentos contra el VIH que bloquean el virus de la unión a CCR5 o de otra manera hacen que el receptor inactivo. Sin embargo, sólo un puñado de compuestos inhibidores de CCR5 se han desarrollado hasta el momento – y nadie sabe exactamente cómo funcionan .
» Una cosa que nos ha faltado es » imagen » de alta resolución de la estructura molecular del receptor CCR5 que podemos utilizar para el diseño preciso de drogas», dijo Wu.
En busca de Seis Años
Wu llegó al laboratorio de Stevens en TSRI en 2007 para llevar a cabo la investigación postdoctoral en las dos co – receptores CCR5 y CXCR4 del VIH alternativa co-receptor del VIH. Una minoría de cepas de VIH CXCR4 en lugar de utilizar CCR5 como co-receptor con CD4 para su infiltración inicial de las células.
«Su objetivo desde el principio fue determinar las estructuras y comprender las funciones de estas dos co-receptores del VIH y estaba muy decidido , que fue inspirador «, dijo Stevens.
Wu pasó sus años postdoctorales centrándose en CXCR4 , que plantea menos problemas técnicos que CCR5 . Su estudio de la señal de la estructura CXCR4 fue publicado en Science en 2010 . Después de regresar a China para iniciar su propio laboratorio , volvió a la » asignatura pendiente » de la estructura de CCR5.
Tanto CCR5 y CXCR4 pertenecen a una gran familia de receptores de células conocidas como receptores acoplados a proteínas G (GPCR ) . GPCRs son notoriamente difíciles de producir en cantidades útiles para el análisis estructural. Con sus estructuras flexibles , sino que también son muy difíciles de convencer a los ordenados , formaciones sólidas de moléculas individuales – » cristales » necesaria para la determinación de la estructura por cristalografía de rayos- X . Eventualmente, sin embargo , con la ayuda de conocimientos adquiridos durante el proyecto CXCR4 , Wu como un nuevo profesor y su joven equipo de estudiantes utilizan una novela «fusion partner» molécula que obstaculicen las proteínas CCR5 juntos lo suficiente para formar cristales utilizables.
Al igual que en la mayoría de los proyectos de receptor – estructura , Wu y sus colegas estabilizaron más CCR5 con un compuesto que se sabe que se unen a ella , en este caso el fármaco Pfizer maraviroc ( vendido bajo el nombre de marca Selzentry ® , o Celsentri ® fuera de los EE.UU. ) . Comercializado por la infección por el VIH desde 2007 , juego de CCR5 maraviroc mantienen de una manera que impide que el VIH mediante el receptor para entrar en las células . » Fue pensado para bloquear CCR5 maraviroc en una conformación inactiva , por lo que quería » ver » que la conformación a alta resolución», dijo Wu.
Los datos de cristalografía resultantes , siempre que la imagen de grano fino de la conformación del VIH resistente del CCR5 . Los datos también revelaron sitio de unión precisa de maraviroc en CCR5 un sitio desde el que la molécula de fármaco influye claramente cómo funciona el receptor , a pesar de que es independiente de los sitios sobre el receptor que se piensa que son utilizados por el VIH . El sitio de unión maraviroc también es diferente de la utilizada por el sitio de unión de la pareja naturales de CCR5 , un conjunto de proteínas inmunes llamadas quimiocinas . Maraviroc por lo tanto parece actuar contra el VIH indirectamente : no por el bloqueo físico del virus , pero mediante el bloqueo de la estructura del receptor en una conformación VIH – insensible.
» Los detalles estructurales pueden ofrecer tremenda visión de cómo las proteínas y drogas de trabajo, también ayudar al desarrollo de agentes terapéuticos «, dijo Peter Preusch , PhD, del Instituto Nacional de Ciencias Médicas Generales , que ayudó a financiar la investigación junto con otro componente de la Nacional los Institutos de la Salud , el Instituto Nacional de Alergias y Enfermedades Infecciosas. «Este estudio proporciona conocimientos sobre las interacciones entre el maraviroc y CCR5 , un objetivo para el tratamiento anti-VIH , que nos ayuda a entender cómo funciona el medicamento en el nivel molecular y podría permitir nuevas exploraciones de la biología del VIH y enfoques para mejorar fármacos dirigidos a estas interacciones.»