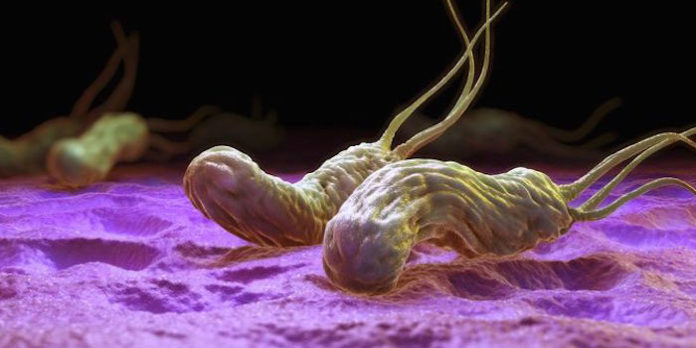
La bacteria gástrica Helicobacter Pylori coloniza los estómagos de alrededor de la mitad de la población humana y puede conducir al desarrollo de cáncer gástrico. Por lo general, se adquiere en la infancia y persiste toda la vida, a pesar de una fuerte reacción de defensa inflamatoria en la mucosa gástrica.
Dicha inflamación normalmente es beneficiosa, ya que mata a los patógenos invasores y luego se resuelve. En el caso de H. pylori, sin embargo, la inflamación nunca logra eliminar al invasor, y en cambio persiste durante décadas, lo que es una fuerza motriz en el desarrollo de úlceras y cáncer.
Si bien muchas bacterias persistentes dependen de la prevención de la detección inmune, la persistencia en medio de la inflamación aguda es una hazaña muy poco común para un patógeno, y hasta ahora no está del todo claro cómo Helicobacter puede hacerlo. Ahora, los investigadores del Instituto Max Planck para la Biología de las Infecciones en Berlín han descubierto que al extraer el colesterol de las membranas de las células anfitrionas, H. pylori descompone un componente vital necesario para ensamblar los receptores de los interferones.
Estas citoquinas son moléculas de señalización clave para convocar al sistema inmune adaptativo a la mucosa infectada, y su ausencia genera un nicho en el que las bacterias pueden sobrevivir mientras la inflamación continúa sin disminuir en el área circundante.
Mientras que la gastritis y la úlcera gástrica solían atribuirse al estrés y a los factores dietéticos, en los años ochenta se descubrió que el verdadero culpable es la infección con una bacteria, H. pylori. Este patógeno ahora está clasificado como carcinógeno de tipo I por la OMS, ya que es el principal factor de riesgo para el desarrollo de carcinoma gástrico.
Los intentos de desarrollar una vacuna contra H. pylori no han tenido éxito y los nuevos resultados proporcionan la primera explicación posible de estos fallos: H. pylori bloquea la señal que permitiría a las células infectadas invocar la ayuda del sistema inmune.
Impulsados por su interés en comprender los mecanismos mediante los cuales las infecciones bacterianas pueden dar lugar al cáncer, el laboratorio de Thomas F. Meyer ya descubrió hace más de una década que H. pylori expresa una enzima llamada colesterol-α-glucosiltransferasa para extraer el colesterol que necesita de las células anfitrionas. Sin esta enzima, las bacterias no pueden infectar a los ratones. En ese momento, el grupo también observó que el exceso de colesterol en la dieta de los ratones aumentaba la eliminación del patógeno pero empeoraba la inflamación. Exactamente cómo la capacidad de extraer el colesterol estaba vinculada a la evasión inmune no estaba clara en ese momento.
Ahora, las nuevas tecnologías para cultivar células estomacales primarias in vitro han sido fundamentales para resolver este rompecabezas. El laboratorio de Meyer logró reconstituir el epitelio mucoso del estómago, produciendo los llamados «mucosoides» en los que las células gástricas crecen como monocapas con una superficie externa e interna e incluso producen la mucosidad que recubre y protege el estómago. Como resultado, los «mini-órganos» infectados podrían mantenerse vivos durante meses.
El colesterol es requerido para la formación de balsa lipídica
Las células epiteliales gástricas infectadas normalmente convocan a las células inmunitarias y generan factores antimicrobianos que matan a la bacteria. Esta respuesta depende de un factor de señalización inmune crucial producido por las células epiteliales: interferón-γ.
Usando el modelo mucosoide, el grupo descubrió que la bacteria sobrevive como pequeñas microcolonias en la parte superior de las células. Esto resultó ser debido a la ausencia de las denominadas «balsas lipídicas» en las membranas celulares, que son necesarias para el ensamblaje de los complejos receptores de interferón. Sin estos, las células huésped simplemente no respondían al interferón-γ en absoluto. Las balsas lipídicas están hechas de colesterol y su destrucción está mediada por la colesterol-α-glucosiltransferasa de la bacteria.
«Mostrar cómo H. pylori persiste en medio de una inflamación aguda explica toda una serie de observaciones que han desconcertado a los investigadores durante décadas y nos ha llevado a pensar en el escenario de la infección en una luz completamente nueva», dice Pau Morey, primer autor de la estudiar. Francesco Boccellato, quien desarrolló el nuevo modelo in vitro, agrega: «los mucosoides permiten que se investiguen las infecciones estables a largo plazo, y serán una herramienta invaluable para examinar los mecanismos subyacentes a las infecciones de la mucosa, la defensa de la mucosa y la aparición del cáncer».
Más información: Pau Morey et al. Helicobacter pylori reduce el colesterol en las glándulas gástricas para prevenir la señalización del interferón gamma y escapar de la respuesta inflamatoria, gastroenterología (2017). DOI: 10.1053 / j.gastro.2017.12.008
helicobacter pilori sinstema inmunitario